Penne per testare il livello di insulina, lenti a contatto, cerotti, frese dentali, valvole cardiache ma anche apparecchiature da laboratorio per le analisi: tutti questi prodotti fanno parte della categoria dei dispositivi medici per i quali è in corso un grande cambiamento.
Viste le novità introdotte con l’MDR, molte aziende grandi e piccole si trovano ad oggi impreparate di fronte alle scelte da intraprendere e ai passi da compiere.
MDR 2017/745 e IVDR 2017/746: le sfide principali
Classificazioni MD e deadlines codifica UDI
UDI-DI e UDI-PI: la struttura dell’UDI
Stampare l’UDI: come, dove, quando e le eccezioni
Connessione a EUDAMED: modalità
Dal 26 maggio 2021 è in vigore la nuova direttiva dell’UE “Regolamento Europeo Dispositivi Medici” MDR 2017/745 che sostituisce le due direttive UE precedentemente esistenti (MDD and AIMDD) e disciplina la marcatura dei dispositivi medici attraverso l’apposizione di un codice univoco – per la loro tracciabilità lungo la supply chain.
All’MDR si affianca anche il regolamento IVDR 2017/746 per la diagnostica in vitro, che sostituisce il precedente IVDMD, entrato in vigore il 26 maggio 2022.
| 2021 | 2023 | 2025 | 2027 | |
| Marcatura UDI su DM | Classe III | Classe II | Classe I | |
| Marcatura diretta UDI su DM riutilizzabile | Classe III | Classe II | Classe I | |
| Marcatura UDI su dispositivi in vitro (IVD) | Classe D | Classe C e B | Classe A |
L’introduzione delle nuove normative ha un impatto notevole per la maggior parte delle aziende di dispositivi medici e dispositivi in vitro, motivo per cui le deadline di conformità sono state assegnate per priorità, e sono quindi diverse a seconda della classe di rischio a cui appartengono i dispositivi.
La normativa individua infatti 4 categorie di dispositivi medici e 4 categorie di dispositivi in vitro, classificati in ordine crescente a seconda del grado di rischio che comportano per la salute pubblica o del paziente.
Scopri quali sono le deadline di codifica in base a quale categoria appartengono i tuoi Medical Device: scarica il nostro whitepaper.
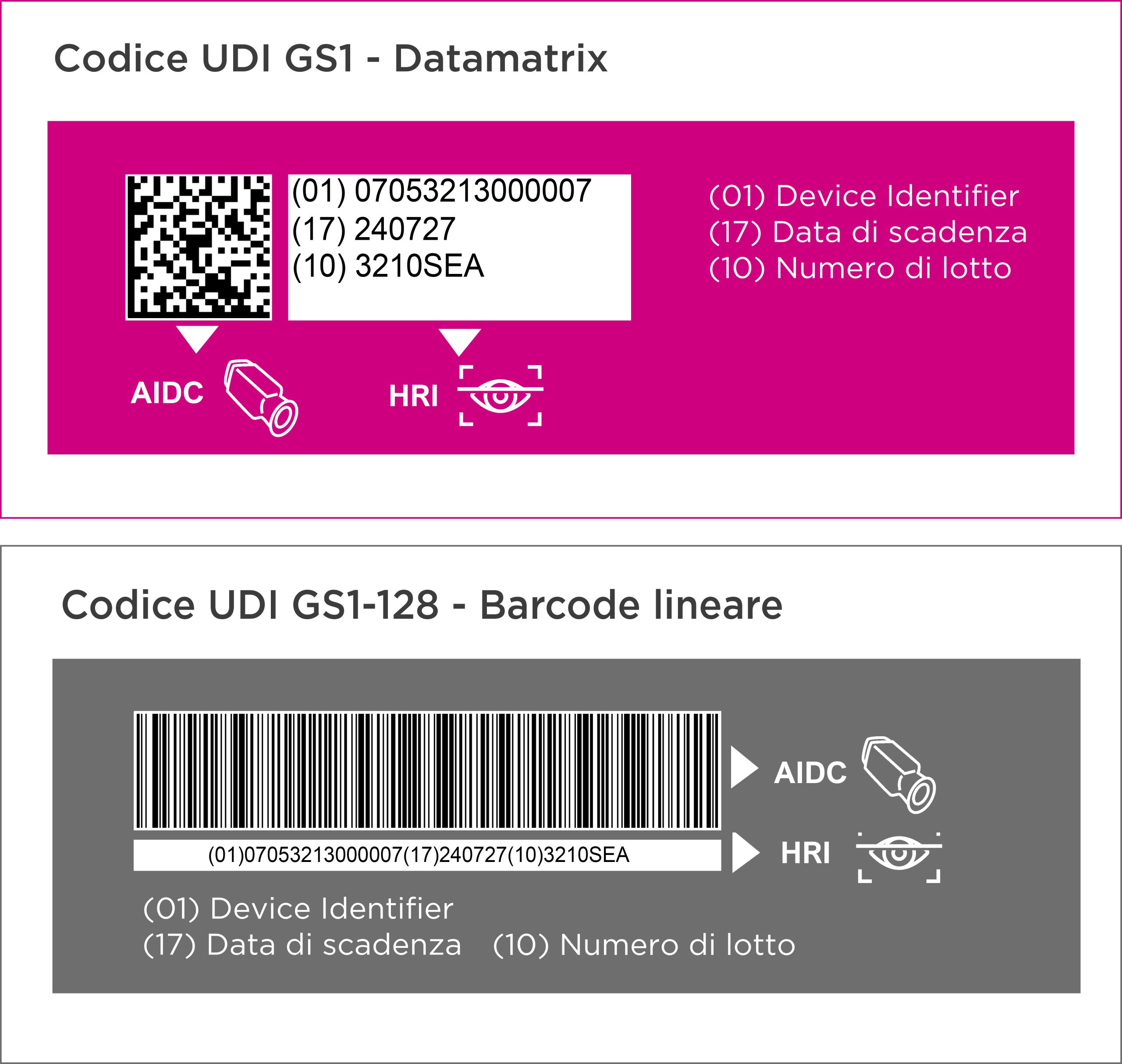
Su ogni dispositvo medico dovrà quindi essere apposto un codice identificativo: l’UDI è un codice univoco ed è la “chiave di accesso” alle informazioni del prodotto registrate su EUDAMED. Il codice UDI può essere numerico o alfanumerico ed è composto da 2 parti:
- Device Identifier (DI): è un codice fisso specifico (max 25 cifre) che identifica una versione o modello di un dispositivo ed il suo fabbricante.
- Production Identifier (PI): è un codice variabile relativo ai dati di produzione del dispositivo, quali numero di lotto, data di scadenza, data di fabbricazione, ecc.
I codici UDI-DI sono emessi da agenzie autorizzate quali: GS1, HIBCC, ICCBBA o IFA – che possono essere scelte liberamente dal produttore dei DM.
l’UDI è un codice univoco ed è la “chiave di accesso” alle informazioni del prodotto registrate su EUDAMED. La parola “univoco” tuttavia non implica che ogni singolo dispositivo debba essere serializzato: la serializzazione dei device nell’UE è obbligatoria solo per i dispositivi impiantabili attivi, come pacemaker e defibrillatori.
L’UDI Carrier è il formato “visibile” dell’UDI e deve essere composto da caratteri leggibili sia in formato HRI sia in formato AIDC. Il fabbricante ha l’obbligo di riportare l’UDI sull’etichetta del device, sull’imballaggio primario, e su tutti i livelli di imballaggio superiori che costituiscono un’unità di vendita.
EUDAMED è il sistema informatico sviluppato dalla Commissione Europea per l’attuazione del Regolamento (UE) 2017/745 sui dispositivi medici (MDR) e del Regolamento (UE) 2017/746 sui dispositivi medico-diagnostici in vitro (IVDR). Il sistema EUDAMED comprende la banca dati centrale per i dispositivi medici ed in vitro che si compone di sei moduli dei quali, ad oggi, ne sono stati attivati tre.
Attualmente l’utilizzo di EUDAMED avviene su base volontaria per i moduli che sono stati resi accessibili. La connessione a EUDAMED dovrà avvenire necessariamente entro 6 mesi dal rilascio pienamente funzionale di tutti i moduli della piattaforma.
È possibile scambiare dati con EUDAMED in 3 diverse modalità, a seconda della quantità di dati da caricare, e del livello di automazione desiderato.